

Tableau périodique pour consultation ou impression.
 jar
jar 
Réactions réversibles.
Animation. On voit comment, dans un système fermé, l'équilibre est atteint quand la vitesse d'évaporation et la vitesse de condensation deviennent égales. À ce moment, la pression de vapeur mesurée par la différence de hauteur de mercure dans les deux branches du tube en "U" se stabilise.
L'animation est dans le haut de la page. C'est la même réaction que celle décrite dans le manuel à la page [ 1.27 ] sauf que les concentrations initiales sont différentes. Cliquez sur "Start" et observez l'évolution des courbes de concentrations en fonction du temps.
Influence sur l'équilibre quand on modifie la concentration des réactifs ou des produits.
Influence sur l'équilibre quand on modifie la concentration des réactifs ou des produits ou que l'on modifie la température.
L'animation se trouve dans le bas de la page. La réaction est la suivante :
C (s) + H2O (g) + chaleur 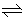 CO (g) + H2 (g) .
CO (g) + H2 (g) .
Faites varier la température. Voyez l'influence sur les quantités à l'équilibre.
Voir l'animation dans le milieu de la page. Varier le nombre de moles d'une espèce avec les curseurs. Remarquer l'influence sur les concentrations (quantités) à l'équilibre des autres espèces.
L'animation se trouve dans le bas de la page. Faites varier le volume en déplaçant le piston avec la souris. Voyez l'influence sur les quantités à l'équilibre.
La réaction est la suivante :
C (s) + H2O (g) + chaleur 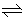 CO (g) + H2 (g).
CO (g) + H2 (g).
Faites varier la température et/ou le volume. Voyez l'influence sur les quantités à l'équilibre. On peut aussi voir l'effet d'un changement de concentration des réactifs et/ou des produits.

Récapitulation
Le principe de Le Châtelier est utilisé pour analyser l'équilibre chimique après la perturbation d'un système.
Équilibre chimique, perturbation d'un système et rééquilibre.
Première animation: cliquer sur un des mots à droite et on voit le déplacement du carbone sur le dessin de gauche.
Cliquer sur les 2 boutons : "Les échanges" et "Tonnage".

Les acides et les bases.
Concentration en ions H+ et pH
Choisissez d'abord le type de solution puis un des composés. Indiquez ensuite la molarité et le volume. Cliquez sur "Insert Probes". On peut calculer à l'avance la valeur du pH. Cliquez sur "Remove Probes" afin de recommencer avec une autre solution.
Relation entre [H+], [OH-], pH et pOH.
Relation entre [H+], [OH-], pH et pOH.
 jar
jar 
Relation entre [H+], [OH-] et pH.
Tableau d'avancement d'une réaction. Lire les instructions.
Tableau d'avancement d'une réaction. Inscrire les coefficients de l'équation de la réaction. Inscrire les quantités de moles des réactifs au départ. Descendre le curseur au centre de la page pour simuler l'avancement de la réaction.
 jar
jar 
Équilibre de dissolution.
Amenez la souris sur le point d'interrogation pour voir les 3 endroits où la loupe apparaît. Cliquez sur l'image de la loupe pour faire apparaître de l'information.
Cliquez sur "Légende", "Caractéristiques" puis "Animation".
Cliquez sur "Légende", "Caractéristiques" puis "Animation".
Détermination du potentiel de différentes piles.
Faites un choix approprié de métaux et de solutions puis cliquez sur l'interrupteur du voltmètre. Vous pouvez prévoir la lecture du voltmètre.
Observez comment fonctionne une pile sèche.
Observez comment fonctionne un accumulateur au plomb d'une automobile.
Observez comment fonctionne un accumulateur au plomb d'une automobile.
Image en couleur permettant de mieux voir comment les piles sont disposées en série dans l'accumulateur.
Observez le fonctionnement d'une pile à combustible H2 - O2. Au moment approprié, cliquez sur "suite".
Figure similaire à la figure 6.9 mais en couleur.
Protection de la coque d'un bateau contre la corrosion.
Amenez la souris sur le point d'interrogation pour voir les 3 endroits où la loupe apparaît. Cliquez sur l'image de la loupe pour faire apparaître de l'information.