

Le manuel dit :
Le système doit être fermé, c'est-à-dire qu'il ne doit échanger ni matière ni énergie avec l'extérieur.
Un système fermé est un système qui n'échange pas de matière avec l'extérieur. On dit plutôt qu'un système est isolé s'il n'échange rien avec l'extérieur: ni matière, ni énergie.
Comme les concentrations de H2 et de I2 passent de 1,0 M à 0,22 M, la réaction a consommé 0,78 M de chacun des réactifs. On a donc produit 2 fois 0,78 M, soit 1,56 M de HI. Le texte et le graphique indique plutôt une valeur erronée de 1,6 M de HI.
La valeur finale de la concentration en HI est de 1,56 M. Modifions le texte du 2e paragraphe et le graphique.
Le manuel nous dit :
« Les systèmes ci-dessous sont initialement à l'état d'équilibre. On les perturbe en modifiant la concentration de l'une des substances, tel qu'indiqué sous l'équation par une flèche... »
En a), le manuel n'indique pas de modification de concentration d'une des substances mais une flèche vers la gauche (  ) indique que la réaction inverse est favorisée.
) indique que la réaction inverse est favorisée.
Il suffit de répondre tout de même à la question.
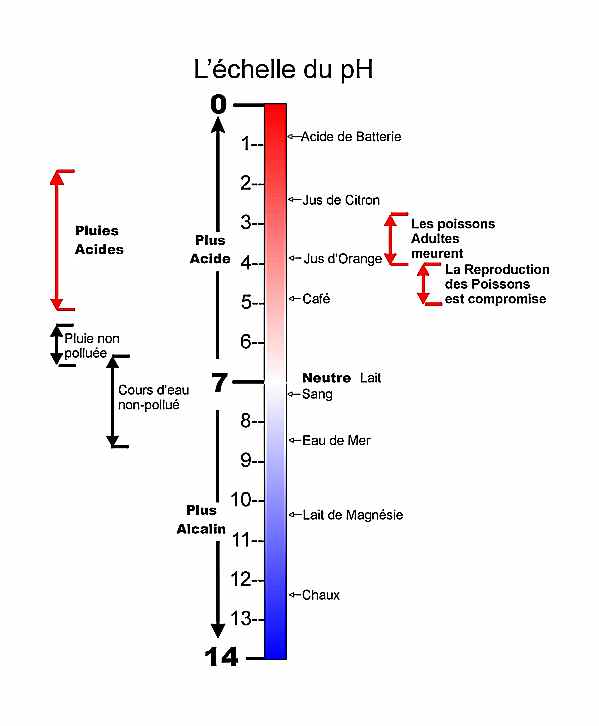
Le manuel nous dit :
« L'échelle des pH s'étend de 1 à 14 et ... »
Remplacer par :
L'échelle des pH s'étend de 0 à 14 et ...
En effet :
Le manuel définit la constante d'acidité mais donne peu d'explications. Ajoutons ceci :
On a vu au chapitre 1 du manuel (voir [ 1.21 et 1.22 ]) que la vitesse de la réaction directe est :
vd = kd [H+] [CH3COOH-]
Aussi, la vitesse de la réaction inverse est : vi = ki [CH3COOH]
Mais, à l'équilibre, on sait que vi = vd , donc :
ki [CH3COOH] = kd [H+] [CH3COOH-]
À partir de cette expression, si on isole (ki / kd), on retrouve l'expression de la constante Ka, telle que définie dans le manuel.
En résumé, la constante d'acidité Ka est une constante d'équilibre de réaction. Son expression mathématique peut être expliquée par l'égalité des vitesses de réaction directe et inverse à l'équilibre.
À la "Page 3.13", on a vu que les réactions de dissociation des acides sont des réactions d'équilibre.
Dans la colonne "Réaction", remplacer les flèches vers la droite
 (réaction directe) par des flèches doubles
(réaction directe) par des flèches doubles 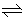 (réaction d'équilibre) quand la valeur de la constante n'est pas "très grande". Dans ce cas, on a bien des réactions d'équilibre.
(réaction d'équilibre) quand la valeur de la constante n'est pas "très grande". Dans ce cas, on a bien des réactions d'équilibre.
On peut laisser les flèches vers la droite  pour les équations dont la valeur de la constante est très grande. La dissociation de l'acide (ou de la base) est alors presque totale.
pour les équations dont la valeur de la constante est très grande. La dissociation de l'acide (ou de la base) est alors presque totale.
L'équation de la transformation de l'acide acétique en éthanol n'est pas balancée. L'équation de la constante d'équilibre devrait probablement être corrigée.
La discussion qui suit reste acceptable.
Dans la colonne "Réaction", remplacer les flèches doubles 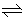 (réaction d'équilibre) par des flèches vers la droite
(réaction d'équilibre) par des flèches vers la droite  (réaction directe) quand la valeur de la constante est "très grande". Il s'agit des 3 premières lignes. La dissociation de l'acide (ou de la base) est alors presque totale.
(réaction directe) quand la valeur de la constante est "très grande". Il s'agit des 3 premières lignes. La dissociation de l'acide (ou de la base) est alors presque totale.
Ceci est conforme à la consigne établie au 2e paragraphe de [ 3.27 ].
Aussi, pour ces 3 mêmes équations, enlever " + H2O " dans le membre de gauche.
Le manuel indique :
« Si l'acide est dissocié à moins de 5 % ... Ce type de calcul sera vu au chapitre 4 pour l'ensemble des systèmes chimiques à l'état d'équilibre. »
Cette note me semble hors contexte. Ce paragraphe conviendrait plutôt s'il était situé complètement dans le bas de la page 3.20.
Si on remplace "l'acide est dissocié à moins de 5 %" par "la base est dissociée à moins de 5 %", alors ce paragraphe conviendrait après le premier paragraphe de la page 3.31 juste avant l'encadré de l'exemple 1.
Le manuel dit :
« Les bases faibles sont le plus souvent des ions que l'on retrouve dans l'équilibre de dissociation d'un acide faible. »
Un peu plus loin, le manuel poursuit :
« HNO2 est un acide faible, et NO2- est une base faible. »
Ajoutons :
Attention ! Cette affirmation pourrait nous faire croire qu'un acide fort aura une base conjuguée forte.
Commençons par définir acide et base conjuguée.
On dit qu'un acide et une base sont conjugués si les deux sont présents en équilibre chimique.
Par exemple, HNO2 est un acide "relativement" faible avec un Ka de 7,2 x 10-4 (Voir fig. 3.5, page 3.15) et sa base conjuguée NO2- est une base faible avec un Kb de 1,4 x 10-11 (Voir fig 3.6, page 3.29).
On constate que Ka Kb = 10-14, comme le montre l'équation dans le bas de la page 3.41.
Quand Ka est grand, Kb est petit. Donc, un acide très fort donne une base conjuguée faible et inversément.
Dans le corrigé :
Remplacer [OH-] = 0,4 mol/L par [OH-] = 0,04 mol/L.
À la ligne suivante, on remplace la réponse et on ajoute les unités de mesure pour [H+] :
2.5 x 10-14 devient 2.5 x 10-13 mol/L.
Dans le corrigé, ajouter les unités mol/L à la réponse indiquée pour [H+]
On a donc : [H+] = 2,5 x 10-13 mol/L
L'équation n'est pas balancée en ce qui concerne les atomes d'oxygène.
Je crois qu'il faudrait ajouter  O2 au membre de droite.
O2 au membre de droite.
Ceci n'affecte pas la discussion qui suit.
Remplacer : « L'échelle s'étend de 1 à 14, ... » par « L'échelle s'étend de 0 à 14, ... ».
Voir la discussion concernant la "page 3.7"
Sous le mot « anion » écrit en petits caractères ou encore à la place du mot « anion », on pourrait écrire "base conjuguée".
En effet, A- est la base conjuguée.
Il faudrait déplacer « acide conjugué » écrit en petits caractères vers la gauche, en dessous de BH. Sa position actuelle, en dessous de OH-, n'est pas correcte.
En effet, c'est BH (ou HB) qui est l'acide conjugué.
Dans le corrigé, remplacer x = 2,4 x 10-7 par x = 2,5 x 10-6.
La correction a été effectuée dans l'édition de janvier 2004.
Dans le corrigé, ajoutons l'explication suivante :
À la page [ 3.41 ] du manuel, on a vu que
Ka Kb = KH2O = 10-14
Un acide fort a un Ka élevé. Ceci a pour conséquence que Kb, la constante de sa base conjuguée a une valeur faible. Donc, la base conjuguée d'un acide fort est une base faible.
Encore une fois (Voir "Page 3.13"), le manuel n'utilise pas les notions vues au chapitre 1 pour définir la constante d'équilibre K.
L'égalité des vitesses de réaction directe et inverse à l'équilibre (voir pages 1.21 et 1.22 du chapitre 1) nous permet d'obtenir l'expression mathématique de la constante d'équilibre K.
À titre d'exercice facultatif :
À la 2e ligne du corrigé :
Remplacer
« Le système réagit en favorisant la réaction inverse. »
par
Le système réagit en favorisant le réaction directe.
L'erreur était corrigée à la réédition de janvier 2004, mais il faut remplacer "direct" par "directe".
Dans le corrigé, on trouve le calcul suivant :
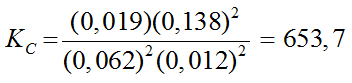
En principe, le produit ou le quotient doit être exprimé avec le même nombre de chiffres significatifs que le facteur qui en contient le moins.
Il faudrait donc remplacer par :
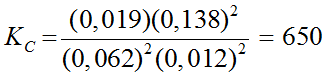
Il est important d'utiliser la fonction "racine cubique" et non "racine carrée".
Ajouter un petit 3 en haut, devant le signe de la racine, un peu avant la fin de la note. On aura donc :
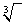 et non
et non 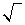 .
.
Si cette fonction n'est pas disponible sur votre calculatrice, utiliser la fonction 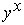 avec x = (1/3).
avec x = (1/3).
Dans le dernier paragraphe du corrigé :
Remplacer :
... car la concentration ne peut être plus grande qu'au départ.
par :
... car si "x" prend cette valeur, les concentrations de SO2 et de NO2 à l'équilibre seront négatives.
Dans l'avant-dernier paragraphe du corrigé :
Remplacer :
... car la concentration de H2O doit avoir diminuée.
par :
... car si "x" prend cette valeur, les concentrations de CO2 et de H2O à l'équilibre seront négatives.
Le corrigé indique « ... le rapport des concentrations ... est momentanément inférieur à la valeur de Kc et ... » .
Il faut remplacer par :
... est momentanément supérieur à Kc.
En effet, [P] est au dénominateur dans l'expression de la constante Kc. Une diminution de [P] entraîne une augmentation du rapport des concentrations. Cette augmentation est temporaire car le système réagit de façon à rétablir l'équilibre et l'expression redevient égale à sa valeur initiale.
Note : Cette erreur n'était pas présente dans la réédition de janvier 2004.
Le corrigé indique « ... le rapport des concentrations ... est temporairement inférieur à Kc » .
Il faut remplacer par :
... est temporairement supérieur à Kc.
En effet, [M] est au numérateur dans l'expression de la constante Kc. Une augmentation de [M] entraîne une augmentation du rapport des concentrations. Cette augmentation est temporaire car le système réagit de façon à rétablir l'équilibre et l'expression redevient égale à sa valeur initiale.
Le corrigé indique : « La valeur 0,556 est à rejeter car la concentration doit avoir diminué. »
Remplacer par :
La valeur 0,556 est à rejeter car il n'y a pas assez de H2(g) et même de I2(g). La concentration de ces réactifs à l'équilibre serait négative, ce qui est évidemment impossible.
Voir le tableau dans le bas de [ C.100 ] du corrigé.
La 3e ligne du tableau commence par : « Ajout (mol/L) »
À la fin de cette ligne, remplacer 2,6 mol/2.4 L = par 0,6 mol/2,4 L =
Dans la réédition de janvier 2004, l'erreur était corrigée.
Le manuel a inversé réduction et oxydation. Corriger :
La première équation est une "demi-réaction d'oxydation" et non de réduction. Cu est le réducteur.
La seconde équation est une "demi-réaction de réduction" et non d'oxydation. H+ est l'oxydant.
Ajouter après l'équation :
Cette définition implique que le calcul du potentiel d'une pile donnera toujours une valeur positive.
Ainsi,  E0 est positif à [ 5.32 ] (équations dans le bas de la page) et à [ 5.35 ] (équations dans le haut de la page).
E0 est positif à [ 5.32 ] (équations dans le bas de la page) et à [ 5.35 ] (équations dans le haut de la page).
À la dernière ligne de [ 5.32 ], le manuel indique le potentiel standard de réduction du zinc :
« Zn2+(aq) + 2 e-  Zn(s) E0 = - 0,76 volt »
Zn(s) E0 = - 0,76 volt »
On a renversé cette équation pour obtenir la deuxième équation de la page 5.33. On devrait donc avoir :
Zn(s)  Zn2+(aq) + 2 e- - E0r = - ( - 0,76 V ) = + 0,76 V
Zn2+(aq) + 2 e- - E0r = - ( - 0,76 V ) = + 0,76 V
On peut maintenant additionner les équations (côté gauche) et les potentiels (côté droit). On obtient :
 E0 = E0r (cathode) - E0r (anode) = 0,00 V - ( - 0,76 V ) = 0,00 V + 0,76 V = 0,76 V
E0 = E0r (cathode) - E0r (anode) = 0,00 V - ( - 0,76 V ) = 0,00 V + 0,76 V = 0,76 V
La soustraction du potentiel à l'anode s'effectue par une addition à cause du renversement de la deuxième équation qui a exigé un changement de signe du potentiel.
À la suite des équations, on trouve ceci :
« On soustrait le potentiel E0r de la réaction d'oxydation parce qu'on a inversé la demi-réaction correspondante. »
Ce paragraphe pourrait être remplacé par :
En additionnant les potentiels, on a bien effectué la soustraction de E0r (anode) puisqu'on a changé le signe du potentiel lors de l'inversion de la demi-réaction correspondante.
Le manuel inverse l'équation du Zn et ne modifie pas le potentiel de réduction. Ensuite, le manuel place un signe - devant le symbole du potentiel de réduction pour qu'on sache qu'il faut le soustraire. Ceci rend la ligne mathématiquement inexacte. Si on souhaite utiliser cette méthode, je crois qu'il faudrait clarifier en ajoutant des parenthèses, comme ceci :
Zn(s)  Zn2+(aq) + 2 e- - ( E0r = - 0,76 V )
Zn2+(aq) + 2 e- - ( E0r = - 0,76 V )
La solution précédente me semble plus simple et plus rigoureuse.
Dans le schéma, il y a une erreur dans le branchement du voltmètre.
Intervertir les fils connectés au voltmètre. Le fil en provenance de l'électrode de référence, à gauche, se branche sur la borne positive du voltmètre i.e. la borne du haut. L'autre fil en provenance de l'électrode de droite se branche sur la borne négative du voltmètre i.e. la borne du bas.
L'erreur a été corrigée dans une version ultérieure du manuel.
La discussion est identique à celle de la "Page 5.33"
Sur la ligne qui concerne le cuivre, on devrait lire :
Cu(s)  Cu2+(aq) + 2 e- - E0anode = - ( 0,34 V ) = - 0,34 V oxydation
Cu2+(aq) + 2 e- - E0anode = - ( 0,34 V ) = - 0,34 V oxydation
On fait ensuite l'addition des deux équations et des valeurs numériques de potentiel.
La discussion est identique à celle de la "Page 5.33"
Sur la ligne qui concerne le zinc dans le corrigé, on devrait lire :
Zn(s)  Zn2+(aq) + 2 e- - E0r = - ( - 0,76 V ) = + 0,76 V
Zn2+(aq) + 2 e- - E0r = - ( - 0,76 V ) = + 0,76 V
On fait ensuite l'addition des deux équations et des valeurs numériques de potentiel.
La discussion est identique à celle de la "Page 5.33"
Sur la ligne qui concerne le zinc dans le corrigé, on devrait lire :
Zn(s)  Zn2+(aq) + 2 e- - E0r = - ( - 0,76 V ) = + 0,76 V
Zn2+(aq) + 2 e- - E0r = - ( - 0,76 V ) = + 0,76 V
On fait ensuite l'addition des deux équations et des valeurs numériques de potentiel.
Dans le corrigé, modifions la 2e ligne d'équations.
Remplaçons
E°cathode = ΔE° - E°anode par
E°cathode = ΔE° + E°anode.
L'erreur a été corrigée dans une version plus récente du manuel.
La discussion est identique à celle de la "Page 5.33"
À la fin de la ligne qui concerne l'aluminium dans le corrigé, on devrait lire :
- E0anode = - ( -1,66 V ) = + 1,66 V
On fait ensuite l'addition des deux équations et des valeurs numériques de potentiel.
À la 3e ligne à partir du bas, le nombre d'oxydation du I2 est 0 et celui du S est -2.
Remplacer la 4e ligne à partir du bas :
+6 -1 -2 0 par +6 -1 0 -2
Dans l'énoncé et dans le corrigé :
Remplacer Cu(NO3)3 par Cu(NO3)2
L'erreur a été corrigée dans une version plus récente du manuel.
La discussion est identique à celle de la "Page 5.33"
À la fin de la ligne qui concerne le chlore dans le corrigé, on devrait lire :
- E0anode = - ( 1,36 V ) = - 1,36 V
On fait ensuite l'addition des deux équations et des valeurs numériques de potentiel.
Dans le schéma de droite qui concerne la pile électrolytique :
Inverser la polarité de la pile (celle qui prend la place du voltmètre) :
"-" à gauche et "+" à droite devient
"+" à gauche et "-" à droite.
L'erreur était corrigée à la réédition de janvier 2004.
Dans l'énonce de la question :
Remplacer
4 NO3 + C  ... par
HNO3 + C
... par
HNO3 + C  ...
...
L'erreur était corrigée à la réédition de janvier 2004.
Dans le corrigé, à gauche de la dernière ligne :
Remplacer
Cl2 + Cu  Cl- + Cu2+ par
Cl2 + Cu
Cl- + Cu2+ par
Cl2 + Cu  2 Cl- + Cu2+
2 Cl- + Cu2+
L'erreur était corrigée à la réédition de janvier 2004.
Dans le corrigé :
Remplacer :
Il faut donc utiliser une cuillère en cuivre par
Il faut donc utiliser une cuillère en fer.
L'erreur a été corrigée dans une version ultérieure du manuel.