

Remplacer
"Activité expérimentale 1 - Gaz, liguides et solides" ...
par
"Activité expérimentale 1 - Gaz, liquides et solides" ...
Le manuel indique :
« Pourtant, avec les années, le verre se déforme et s'écoule comme une substance liquide. Des "coulisses" de verre sont visibles sur les vieilles fenêtres installées depuis de nombreuses années. Ces altérations dans le verre déforment le paysage lorsqu'on regarde à travers une fenêtre. »
Il faut éliminer les trois phrases précédentes.
Le manuel fait référence à une croyance se rapportant aux vitraux des cathédrales construites au Moyen-Âge. En effet, le verre des vitraux est plus épais à la base qu'en haut. Il semble avoir coulé avec le temps. En réalité, c'est dans cette condition que se trouvait le vitrail tout juste après sa fabrication. On installait la partie la plus épaisse dans le bas. Les études sérieuses semblent prouver qu'il faudrait des millions d'années pour observer une déformation du verre de l'ordre du millième de millimètres.
Cependant, si on considère la structure de ses molécules, il reste difficile de décider si le verre est un solide, un liquide ou quelque chose entre les deux car il présente à la fois des propriétés de l’état liquide et d’autres de l’état solide.
Voir l'explication donnée à la "page [ 1.53 ]". Remplacer la réponse donnée dans le manuel par celle-ci :
Le verre a l'apparence d'un solide mais les molécules du verre sont désordonnées comme celles d'un liquide.
Le manuel indique :
« Pour arriver en même temps à l'arrière, l'air circule donc plus rapidement au-dessus de l'aile ... »
Il est vrai de dire que la vitesse de l'air est plus grande en haut de l'aile et qu'elle est plus petite en bas. Cependant, on ne peut pas affirmer que l'air venant par le haut et par le bas de l'aile arrive en même temps à l'arrière de l'aile.
Voir les documents suivants.
Le manuel indique :
« Lorsqu'on diminue le volume, la surface des parois contenant le gaz diminue. En considérant que le nombre total de collisions n'a pas changé, la même force totale est appliquée sur une plus petite surface. L'équation mathématique p = F / A indique clairement qu'une diminution de surface entraîne une augmentation de la pression. Ainsi, lorsque le volume d'un contenant diminue, la surface des parois diminue et la pression augmente. En d'autres mots, on peut dire que la surface est inversement proportionnelle à la pression. »
Il n'est pas approprié de dire que le nombre total de collisions n'a pas changé. La conclusion devrait être que la pression est inversement proportionnelle au volume (loi de Boyle-Mariotte que nous allons voir) et non à la surface.
On remplace par :
En faisant descendre le piston, donc en diminuant le volume, la surface totale des parois contenant le gaz diminue. Comme p = F / A, une diminution de surface entraîne une augmentation de pression.
De plus, un plus grand nombre de molécules d'air (dont le nombre n'a pas varié) se trouvent près d'une paroi. Les molécules d'air vont donc frapper la paroi plus souvent. Cela fera augmenter le nombre moyen de collisions des molécules sur les parois par unité de temps (la fréquence des collisions). Par conséquent, la force exercée par unité de surface sur les parois va augmenter. Encore une fois, comme p = F / A, une augmentation de force entraîne une augmentation de pression.
Ainsi, ces deux facteurs (F augmente et A diminue) contribuent à faire augmenter la pression quand le volume diminue.
Le texte indique :
À 50 mètres de profondeur, le poids de l'eau exerce une pression 6 fois supérieure à celle de l'air.
Remplaçons par :
À 50 mètres de profondeur, le poids combiné de la colonne d'eau et de la colonne d'air exerce une pression 6 fois supérieure à celle de la colonne d'air à la surface de l'eau.
À la gauche de la figure 3.20 c), il est inscrit pgaz = 50 cm Hg.
Remplacer ce 50 cm Hg par 51 cm Hg.
Il s'agit de la fin de la question b).
Remplacer :
... à l'aide de l'équation p = V k.
par
... à l'aide de l'équation pV = k ou p = k V-1
.
Remplacer : Inverse du volume (L) par Inverse du volume (L-1)
Remplaçons l'équation suivante dans le haut de la page :
T(°C) = 0,56 ( T(°F) - 32 ) par
T(°C) = (5/9) ( T(°F) - 32 )
(5/9) = 0,55555... = 0,56 seulement après avoir arrondi à 2 chiffres significatifs
et le résultat alors obtenu ne sera précis qu'à 2 chiffres significatifs seulement.
Le texte indique :
« ... il choisit 100° pour le point d'ébullition de l'eau et 0° pour le point de congélation. L'année suivante, un fabricant d'instruments inverse l'échelle et lui donne l'apparence que nous lui connaissons aujourd'hui. »
Il faut remplacer par :
... il choisit 0° pour le point d'ébullition de l'eau et 100° pour le point de congélation.
En effet, l'échelle proposée initialement par Celsius était à l'inverse de l'échelle que nous connaissons maintenant. L'échelle reprit rapidement sa configuration actuelle et aujourd'hui 0°C correspond au point de congélation de l'eau et 100°C est le point d'ébullition de l'eau.
Le méthane brûle par l'équation de combustion suivante : CH4 + 2 O2  CO2 + 2 H2O.
CO2 + 2 H2O.
L'équation utilisée dans cette question est une réaction entre le méthane et la vapeur d'eau.
Dans l'énoncé de la question, remplacer :
... si on brûle 100 kg de méthane. par ... si on utilise 100 kg de méthane.
Dans la partie b) de la question, remplacer :
... de méthane brûlé. par ... de méthane utilisé.
À la fin de la question, il peut être bon de souligner que :
Une tonne (métrique) = 1 000 kg = 1 000 000 g
Dans le corrigé, on indique : n1 = 1 mol, n2 = 1 mol.
Il n'y a pas 1 mole de H2 et 1 mole de Cl2.
Cependant, le rapport entre le nombre de moles de H2 et Cl2 est bien 1.
Dans le corrigé, en a), à la 4e ligne, le manuel arrondit incorrectement et donne un résultat erroné de 0,00409 mol. En fait, le résultat est 0,00399777 mol. En conservant 3 chiffres significatifs, on obtient 0,00400 mol.
Il faut remplacer 0,00409 mol par 0,00400 mol.
En b), le manuel poursuit avec le résultat erroné de 0,00409 mol et calcule une masse molaire de 57,9 g qui est proche de celle du butane dans le tableau de [ 6.19 ] et non du triméthylamine.
Il faut remplacer 0,00409 mol par 0,00400 mol à deux endroits.
Il faut aussi remplacer le résultat du calcul 57,9 g par 59,2 g.
La figure 7.21 montre un diagramme de Lewis du monoxyde de carbone avec une liaison double entre l'atome de carbone et l'atome d'oxygène.
En fait, la structure électronique simple qui représente le plus fidèlement la molécule de CO contient une liaison triple. On peut représenter la distribution des électrons par ce dessin :

Les 6 électrons dans le milieu du dessin (2 en rouge fournis par l'atome C et 4 en vert fournis par l'atome O) sont partagés par les deux atomes. Chaque atome (C et O) possède 2 électrons non partagés et complète sa couche de valence à l'aide des 6 électrons mis en commun. Ces 6 électrons contribuent à former une liaison triple :
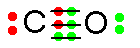
Il faudrait enlever ou modifier le texte (et la figure) débutant au milieu de la [ 7.21 ] : « Considérons maintenant le cas particulier du monoxyde de carbone » ... et se terminant à la 1e ligne de [ 7.22 ] : « Le cas du monoxyde de carbone est exceptionnel. »
On ne peut pas dire que l'énoncé 3 est faux. Il est bien sûr incomplet. Pour éviter une ambiguïté :
Remplacer : Les molécules tournent sur elles-mêmes et vibrent.
par :
Les molécules ont 2 types de mouvement seulement : elles tournent sur elles-mêmes et vibrent.
Alors, l'énoncé devient faux.