(Vocabulaire) Lixiviation :
Extraction des constituants d’un composé soluble, au moyen d’un solvant.
(Vocabulaire) Tributaire :
Se dit d’un cours qui se jette dans un autre cours d’eau ou dans une étendue d’eau.
Un fleuve tributaire d’une mer. Une rivière tributaire d’un fleuve.
À la page [ 1 • 39 ] - [ 1.8 ], dans la fumée du bateau, on peut lire les mots "Dépôt sec". Aussi, à la page [ 1 • 57 ] - [ 1.31 ], le manuel nous dit :
« Lorsqu'on l'emploie dans son sens générique, le terme "pluies acides" regroupe aussi les notions de dépots secs, brouillard, neige, grêle, rosée, nuage, grésil. On peut aussi alors parler de précipitations acides. »
Cependant, on n'explique pas en quoi consiste un dépot sec. On pourrait, par exemple, ajouter le texte suivant après le 3e paragraphe de la page [ 1 • 44 ] - après le 2e paragraphe de la page [ 1.15 ] :
En fait, on devrait parler de "dépôts acides" plutôt que de "pluies acides". En effet, les "dépôts acides" englobent les dépots humides (pluie, neige, etc.) et les dépôts secs.
Origine des dépôts acides :
Une partie de ces dépôts acides sont d'origine naturelle. Le problème survient quand des polluants atmosphériques comme le dioxyde de soufre (SO2) et les oxydes d'azote (NOx) sont générés en grande quantité par l'activité humaine.
Dépôts humides :
Une fois rendus dans l'atmosphère, ces polluants peuvent se mélanger à la vapeur d'eau et se convertir en acide sulfurique (H2SO4) et en acide nitrique (HNO3). Dilués, ces acides retombent au sol sous forme de pluie, brouillard, grêle, rosée, grésil, etc. Il s'agit alors de "dépôts humides".
Dépôts secs :
Privés d'humidité, les acides peuvent aussi se présenter sous la forme de gaz ou se combiner à d'autres molécules et former des particules sèches. Éventuellement, sous l'effet de la gravité, cette poussière acide se dépose sur le sol. On parle alors de "dépôts secs". Ce phénomème est loin d’être négligeable.
Voir aussi une définition de "Dépôt sec" dans le vocabulaire, en annexe, page [ 431 ] - [ C.97 ].
(Vocabulaire) Ruissellement :
Écoulement des eaux pluviales sur un versant.
Ruissellement pluvial. Les eaux de ruissellement.
(Vocabulaire) Maurelle :
Variété de croton dont on tire un colorant brun, appelé tournesol des teinturiers.
Les crotons : arbustes tropicaux à feuilles persistantes bordées de rouge et dont les graines fournissent une huile toxique purgative.
Le Littré (1880) - Un des noms de la plante au tournesol.
ÉTYMOLOGIE - Maure, à cause du suc foncé qu'elle fournit.
Au 2e paragraphe, [ 2 • 75 ] - Au 3e paragraphe, [ 2.17 ], le manuel présente une définition de "masse atomique" :
« La masse atomique d'un élément correspond à la masse moyenne de ses atomes et elle s'exprime en unités qui correspondent presque exactement à la masse d'un proton ou d'un neutron. »
Au milieu de [ 2 • 90 ] - [ 2.34 ], dans le résumé du chapitre, on trouve :
« La masse atomique d'un élément est égale à la masse moyenne de ses atomes, en tenant compte de l'abondance relative de ses isotopes. »
On pourrait ajouter en note dans le bas d'une de ces pages :
Nous verrons une autre définition au milieu de [ 5 • 211 ] - début de [ 5.17 ].
La masse atomique d'un élément est la masse, exprimée en grammes, d'une mole d'atomes de cet élément. Une mole d'atomes, c'est 6,02 x 1023 atomes.
Enlever :
Figure 2.5 - Carte de l'Europe
Pour le schéma du potassium, en bas à droite, il manque une 4e couche électronique.
Précisons la démarcation entre les métaux et les non-métaux :
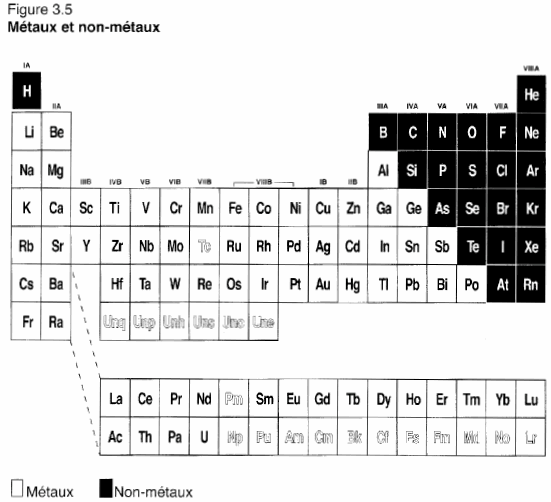
Les métalloïdes ne sont pas présentés ici.
(Vocabulaire) Alcali :
Nom générique des bases, oxydes et hydroxydes des métaux alcalins.
Dans le manuel, quand un atome neutre ajoute un ou des électrons supplémentaires à ses électrons de valence, ces électrons supplémentaires sont représentés sur le diagramme de Lewis avec un symbole qui permet de les distinguer des électrons qu'il avait au départ. Voir, par exemple, à la [ 3 • 121 ] - [ 3.23 ], le diagramme de Lewis de l'oxygène et de l'azote.
Pour rester fidèle à cette pratique, dans le corrigé, il faudrait donc remplacer :
b) 2 points noirs sur le diagramme du soufre par 2 cercles.
c) 1 point noir sur le diagramme du fluor par 1 cercle. (Voir le bas de la page 3.22)
f) 3 points noirs sur le diagramme de l'azote par 3 cercles. (Voir le haut de la page 3.23)
i) 3 points noirs sur le diagramme du phosphore par 3 cercles.
Après l'énoncé du numéro (m), il y a une figure comprenant 4 séries de cercles.
Dans la 2e série de cercles à partir de la gauche, enlever le cercle le plus à l'extérieur. En effet, le fluor ne possède que 2 couches électroniques.
Dans le corrigé, ajoutez un huitième électron, en haut à droite, autour de l'atome de chlore.
Dans le corrigé, à la 5e colonne du tableau (celle des anions), il y a une erreur sur les diagrammes de Lewis.
Pour le diagramme de Lewis de O-2, voir à droite de [ 3 • 121 ] - le haut de [ 3.23 ]
Pour le diagramme de Lewis de F-1, voir à droite de [ 3 • 121 ] - le bas de [ 3.22 ]
L'élève qui veut en savoir plus trouvera une explication plus détaillée concernant la dureté de l'eau et les adoucisseurs dans le manuel "Réaction chimiques 2 : équilibre et oxydoréduction", à [ 2.38 ].
(Vocabulaire) Zéolite ou zéolithe :
Silicate naturel hydraté de certaines roches volcaniques.
Dans le corrigé, remplacer :
... les deux atomes de brome ... par ... les deux atomes de chlore ...
et
Br2 par Cl2.
Dans le corrigé, le manuel indique :
« Covalente : l'oxygène et le chlore partagent 1 électron. »
On pourrait être plus précis :
Covalente : l'oxygène partage 1 électron avec chacun des atomes de chlore, soit 2 électrons au total.
En effet, au numéro 3.28 g), on a bien la molécule OCl2 :
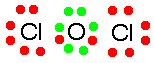
Comment définit-on la liaison quand la différence d'électronégativité est égale à 0,4 ou égale à 1,7 ?
Le manuel introduit ici des exemples de composés ayant des anions (ions négatifs) polyatomiques (avec plusieurs atomes). De plus, ces anions possèdent un seul atome central. Par exemple, dans PO4-3, P est l'atome central autour duquel se trouvent 4 atomes O.
On pourrait énoncer la règle générale de nomenclature utilisée pour les anions polyatomiques ayant un seul atome central :
D'abord, on prend le nom des atomes liés à l'atome central et on ajoute la terminaison "o". (Exemple : chloro pour le chlore, oxo pour l'oxygène). On introduit un préfixe pour indiquer le nombre de ces atomes. Enfin, on termine avec le nom de l'atome central avec la terminaison "ate".
Par exemple :
PCl6- : ion hexachlorophosphate
6 atomes (hexa) de chlore (chloro) liés à l'atome central de phosphore (phosphate)
Autres exemples :
SO4-2 : ion tétraoxosulfate
NO3- : ion trioxonitrate
CO3-2 : ion trioxocarbonate
Pour nommer le composé en entier, on procède comme indiqué dans le manuel.
Dans le bassin de gauche, ajouter une molécule de CH3COOH.
À la 4e ligne à partir du bas de la page, on trouve :
« D'où la proportion : »
Il y a une erreur dans la proportion qui suit cette ligne.
Au dénominateur de la seconde fraction,
remplacer 400 L par 400 mL
La même remarque s'applique à la ligne suivante.
Au dénominateur de la fraction,
remplacer 1 000 L par 1 000 mL
La masse atomique du KMnO4 est : 39,098 + 54,938 + 4 (15,999) = 158,032 g.
1 g de KMnO4 correspond donc à 0,00633 mol alors que dans le corrigé, on arrondit à 0,006 mol.
Ceci correspond à un seul chiffre significatif, en accord avec la donnée initiale de 1 g qui ne contient, elle aussi, qu'un seul chiffre significatif.
Cependant, si on conserve plus de chiffres significatifs, on obtient c = 0,0253 M au lieu de c = 0,024 M
On pourrait remplacer la donnée initiale de 1 g par 1,00 g et modifier les résultats en conservant plus de chiffres significatifs.
Dans le corrigé, au moment de remplacer les variables situées au numérateur par leurs valeurs, on fait une inversion. Par exemple, on indique c2 V2 mais on remplace comme si on avait dit V2 c2.
Selon les sources consultées, le point de virage du carmin d'indigo serait de 11,4 à 13,0 :
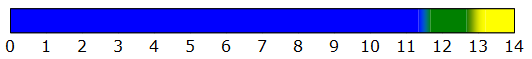
Pour le carmin d'indigo, remplacer "... de 12,0 à 14,0 ..." par ... de 11,4 à 13,0 ....
Dane le corrigé, remplacer " ... supérieur à 12,0 " par ... supérieur à 13,0
Si on ne modifie pas le point de virage, il faut s'attendre à une zone de vert en haut de pH = 12 qui se termine
avec une zone jaune un peu avant pH = 14. On aurait ceci :
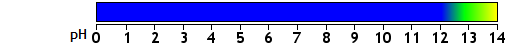
La zone de pH pour laquelle la solution prend une coloration jaune est plus difficile à identifier clairement.
Comme on le mentionne au tableau dont il est question, les points de virage du rouge de méthyle sont 4,4 et 6,2 :
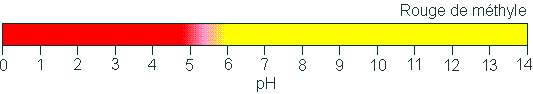
L'énoncé de l'exercice 5.34 d, est :
Une solution se teinte de rouge dès qu'on lui ajoute du rouge de méthyle.
On peut se demander ce que l'on entend par "se teinte de rouge". En effet, entre les points de virage, c'est-à-dire entre 4,4 et 6,2, on voit que la solution se teinte de rouge, sans être totalement rouge. On a un dégradé de jaune se déplaçant vers le rouge en descendant de 6,2 vers 4,4.
Conservons la réponse du corrigé, soit « pH inférieur à 4,4 » et
remplaçons "se teinte de rouge" par vire au rouge.
Dans le corrigé, au dernier calcul des numéros (a) à (e), remplacer ml par mol au numérateur.
Dans le corrigé, le calcul d'une mole de H2SO4 donne bien 98,1 g. Cependant, un peu plus loin, au moment de faire la règle de trois, on divise par 98,01 g.
Dans le corrigé, remplacer 98,01 g par 98,1 g au dénominateur.
Modifiez le corrigé :
Remplacer :
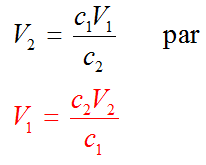
En effet, la solution de départ est logiquement désignée par l'indice 1. C'est donc bien V1, le volume de la solution de départ que nous calculons.
Modifiez l'énoncé de la question :
Remplacer "Un échantillon de Ba(OH)2 est dissous" ...
par "Un échantillon de 51,24 g de Ba(OH)2 est dissous" ...
Modifiez le corrigé [ 410 ] :
Dans le remplacement de la formule, remplacer le dénominateur :
0,25 ml par 0,25 M.
Environ au 2/3 de la page, 2 lignes plus bas que la phrase : « Balançons l'équation pour O. »,
on fait le décompte des atomes d'oxygène pour chaque espèce chimique.
Dans la 3e colonne, on fait le calcul du nombre d'atomes de O correspondant au 6 molécules de CO2.
Remplacer 2 atomes de O ...
par 12 atomes de O ...
Ne pas faire l'exercice f) car il est beaucoup plus difficile que les autres.
Voici une solution possible. ![]()
Au dénominateur, remplacer 1 mol de SO3 par 2 mol de SO3.
Remplacer la fin de la ligne C, c'est-à-dire que :
HNO3 + NH4OH  NH4NO3 + HO
NH4NO3 + HO
devient
HNO3 + NH4OH  NH4NO3 + H2O
NH4NO3 + H2O
Il manque "1. Les aspects scientifiques" et "2. Les aspects environnementaux" que l'on retrouvait dans l'ancienne version de ce livre.
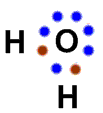
Dans le corrigé, à la 4e ligne, il y a une erreur dans le diagramme de Lewis de la molécule d'eau (H2O), c'est-à-dire celle contenant O et H.
Remplacer le diagramme indiqué par un des 2 diagrammes suivants :